LEER ATENTAMENTE LAS INDICACIONES
ANTES DE TRANSCRIBIR.
NOTA: La siguiente guía debe ser
RESUELTA en el cuaderno del estudiante, por tanto, debe ir tal y como se
encuentra organizado, es decir con la fecha, semana y tema.
Marzo 27 de 2020
Semana 8
Área: Ciencias
naturales – Química
Grado:
10°
Competencia: indagación
Componente: ciencia tecnología y sociedad
Evidencia de
aprendizaje: Establece la relación entre la distribución de los
electrones en el átomo y el comportamiento químico de los elementos, explicando
cómo esta distribución determina la formación de compuestos, dados en ejemplos
de elementos de la Tabla Periódica.
Tema: Enlaces químicos – enlaces covalentes
“La dicha de la vida consiste en tener siempre algo que hacer, alguien a quien amar y alguna cosa que esperar”. Thomas Chalmers
ACTIVIDAD INTRODUCTORIA
En nuestro hogar encontramos varios compuestos en los
cuales los átomos están unidos por medio de enlaces covalentes, por ejemplo, la
sal es un compuesto común que normalmente encontramos en forma de pequeños cristales;
el agua naturalmente líquida y el oxígeno molecular en forma de gas. Si todos
presentan enlaces covalentes. Explica ¿Por qué están en diferentes formas en
la naturaleza?
INTRODUCCIÓN
Las moléculas de los compuestos
covalentes , enlazan sus átomos formando estructuras geométricas, con ángulos
perfectamente definidos, debido a, una serie de fuerzas que mantienen unidos
los átomos y también a la disposición espacial de los núcleos de los mismos.
Este arreglo está relacionada directamente con la repulsión entre los
electrones que forman el enlace entre aquellos electrones no enlazados
presentes en las moléculas, las cuales se mantienen unidas por las
interacciones de Van der Waals.
ACTIVIDAD 1.
1. Realiza un resumen consignando la
información más importante en tú cuaderno.
2. Realiza un mapa conceptual donde relaciones las distintas fuerzas
intermoleculares.
FUERZAS INTERMOLECULARES
De acuerdo con
los modelos de enlace estudiados anteriormente la estabilidad alcanzada por los
átomos e iones al originar las moléculas sería máxima (configuraciones de gas
noble en la mayor parte de los casos). Bajo este supuesto no era de esperar
nuevas interacciones entre éstas. Sin embargo, la existencia de fuerzas que
atraen entre sí a las moléculas no puede dudarse desde el momento en que todos
los compuestos, hasta los gases nobles, pueden condensarse y solidificarse.
La mayoría de
esas fuerzas intermoleculares son de tipo electrostático y se originan por la
atracción entre dipolos, recibiendo el nombre genérico de Fuerzas de Van der
Waals. Las energías de estas uniones son mucho menores que las de los enlaces
iónico y covalente. Estas fuerzas permiten explicar el comportamiento de la
mayoría de los compuestos con enlaces covalentes. Se observan sin embargo
algunos compuestos, algunos tan importantes como el agua o el amoníaco, para
los cuales las energías de las fuerzas intermoleculares son muy superiores a
las que pudieran originarse mediante enlaces de Van der Waals, aunque muy
pequeñas para ser enlaces iónicos o covalentes. Todos estos compuestos tienen
en común la presencia de átomos hidrógeno que participan en las uniones
formadas, por este
motivo este tipo
de enlace se denomina enlace por puente de hidrógeno o simplemente enlace de
hidrógeno (nunca debe decirse simplemente puente de hidrógeno).
Las fuerzas
intermoléculares o de Van der Waals son:
·
Fuerzas Dipolo-Dipolo: Fuerzas
de Keeson
Son las más
frecuentes e intensas. Se establecen entre moléculas polares. Las moléculas se
orientan por sí mismas de forma que se enfrentan los polos de signo contrario de
moléculas contiguas. Los dipolos se atraen entre sí y el ordenamiento se
extiende a todo el material. Evidentemente estas fuerzas serán más intensas
cuanto mayor sea la polaridad de las moléculas y también cuanto mayor sea el
tamaño de los átomos que las constituyen, dado que los dipolos serán más
intensos cuanto mayor sea el número de electrones involucrados.
Ejemplo: En lás
moléculas de ácido clorhídrico (HCl), un átomo de hidrógeno se entrelaza con el
cloro, un elemenento más electronegativo, por tanto el enlace covalente va a
estar mucho más cerca del átomo de cloro que del hidrógeno. Cómo resultado, se
produce una zona con mayor densidad de carga negativa en el átomo de cloro y
otra zona con un defecto de carga positiva en el hidrógeno. Formándose así un
dipolo permanente.
 |
| Ácido Muriático |
·
Fuerzas Dipolo Instantáneo-Dipolo Inducido: Fuerzas de
London
Son
las de menor intensidad, pero muy importantes pues son las que cohesionan las
moléculas de los compuestos apolares, como el Cl2, así como las moléculas
monoatómicas de los gases nobles. El movimiento continuo de los electrones
alrededor del núcleo origina situaciones en las que la distribución de cargas
no es homogénea, es decir dipolos instantáneos. La polaridad de estos dipolos
cambia rápidamente con el tiempo con lo cual el
momento
resultante es cero. Pero si el sistema está a una temperatura lo suficientemente
baja, los movimientos de reordenación serán muy lentos de manera que un dipolo
instantáneo tiene tiempo para inducir otro dipolo en una molécula vecina y ésta
a su vez en otra, etc., de manera que se extiende la polarización a todo el
material y se produce la cohesión entre todas las
moléculas.
Evidentemente la magnitud de estas fuerzas aumenta con el tamaño de las
moléculas. Cuanto mayor es el tamaño más lejos del núcleo están los electrones
y por tanto más fácilmente polarizable es la molécula.
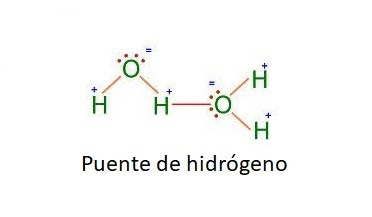
Puentes de
El
enlace de hidrógeno es una fuerza intermolecular mucho mayor que las otras. Se
ha observado fundamentalmente en sistemas en los que se unen F, O, N (y con
mucha menor fuerza Cl) al hidrógeno.
Puede
darse entre átomos iguales: X-H...X o diferentes: X-H...Y, siendo más fuerte
cuanto mayor es la electronegatividad de los átomos unidos, y menor la
diferencia de electronegatividades entre X e Y.
La
naturaleza de esta interacción es compleja, no corresponde únicamente a una
fuerza dipolo-dipolo, aunque ésta sea el primer paso en el establecimiento del
enlace. La fuerte atracción electrostática entre un dipolo X-H y otro Y-H hace
que un par de electrones sin compartir del átomo Y sea atraído por el átomo de
hidrógeno deslocalizándose parcialmente sobre un orbital vacío, distinto del
1s, del átomo de hidrógeno, originándose una especie de enlace covalente,
aunque no tan fuerte como un enlace covalente normal por la aparición de
fuerzas repulsivas entre los átomos X e Y, ambos con carga parcial negativa.
Por eso el enlace de hidrógeno es más fuerte que uno dipolo-dipolo, pero menos
que uno covalente.
Los
enlaces de hidrógeno son los responsables de muchas de las anómalas propiedades
del agua que, como sus elevados puntos de fusión y ebullición, su alta
capacidad calorífica o su elevada tensión superficial, tanta importancia poseen
para el desarrollo de numerosos procesos biológicos.
La
causa de esta anómala variación de densidad radica en los enlaces de hidrógeno.
En el hielo, y debido a estos enlaces se forma una estructura muy abierta, con
una coordinación 4 para cada molécula de agua, quedando numerosos espacios vacíos
en la estructura lo que provoca una disminución de densidad importante. Al
aumentar la temperatura parte de los enlaces de hidrógeno se van rompiendo (un
10% a 4 °C), disminuyendo la coordinación hasta aproximadamente 3 y formándose
una estructura más compacta y densa. Por encima de 4 °C el comportamiento del
agua es semejante al del resto de los líquidos, la movilidad térmica tiende a
separar las moléculas y la densidad disminuye.
Fuerzas Intermoleculares Y Propiedades Físicas
Las
propiedades físicas que presenta un compuesto nos dan idea de su estructura,
y viceversa, de la estructura de un compuesto podemos predecir sus propiedades
físicas. Vamos a considerar la variación de tres propiedades físicas concretas.
a) Punto de
fusión: Para que un sólido funda hay que romper una gran parte de sus enlaces
intermoleculares (interiónicos, si se trata de un compuesto iónico). Cuanto
mayores sean las fuerzas intermoleculares, mayor será su punto de fusión y
habrá que proporcionar mayor energía para romper esas uniones.
Así,
los compuestos iónicos presentan puntos de fusión superiores a los de los
compuestos covalentes y dentro de éstos, los compuestos polares poseen puntos
de fusión superiores a los apolares.
b) Punto
de ebullición: El paso de un líquido a gas supone la ruptura de todas las
uniones intermoleculares. La energía necesaria para ello dependerá del
tipo de unión.
En
moléculas enlazadas por fuerzas dipolo o de London el punto de ebullición
aumenta al aumentar el tamaño de la molécula y al aumentar la superficie
disponible para interaccionar. Así, en una serie homóloga el punto de
ebullición aumenta a medida que aumenta el número de átomos de carbono.
Solubilidad:
La mayoría de los compuestos iónicos son solubles en agua. Los iones son
solvatados por el agua. En los no iónicos la solubilidad viene determinada por
la polaridad: los compuestos polares se disolverán en disolventes polares y los
no polares en disolventes no polares. La solubilidad de los compuestos
covalentes en agua es una propiedad directamente afectada por el enlace de
hidrógeno. Un compuesto que pueda formar enlaces de hidrógeno con el agua es
más soluble en ella que uno que no los forme
|
Compuesto
|
Pm
|
solubilidad en agua
|
|
Etanol
|
46
|
totalmente soluble
|
|
1-butanol
|
74
|
7,9
g en 100 ml
|
|
Pentano
|
72
|
0,036
g en 100 ml
|
TALLER DE APLICACIÓN
1.
En un conjunto de
moléculas, identifica el tipo de fuerzas intermoleculares que se llevan a cabo
en cada caso.
2.
Señala cuáles de los
siguientes compuestos sólo tienen fuerzas de London: tetracloruro de carbono (
), Pentacloruro de
fósforo (
), cloroetano (
), metanol (
), y cloruro de litio
(
).
3.
Describa las fuerzas
intermoleculares que se esperan en cada uno de los siguientes compuestos: óxido
sulfuroso (
), dióxido de carbono
(
) y metilamina (
).
4.
Un enlace usual es el
formado por el cloruro de yodo (
) sólido, su punto de
fusión es de 26° C; este compuesto en solución se emplea como desinfectante.
¿Cómo son sus moléculas? ¿qué fuerzas las mantienen unidas? Argumenta tú
respuesta.
5. Los siguientes
enunciados muestran las características de las diferentes fuerzas
intermoleculares. Relaciónalas e identifícalas y escribe sus nombres en su
cuaderno.
- Aunque no se trata de una unión intermolecular, la formación de dipolos explica que ocurren entre un ion positivo o negativo y el dipolo de carga opuesta de solvente polar.
- Son interacciones entre dipolos transitorios y es una característica de moléculas apolares.
- La parte negativa de la molécula es atraída por la parte positiva de la otra molécula.
6.
¿Cuál es la
diferencia entre las fuerzas de London y los puentes de hidrógeno? Da dos
ejemplos de cada caso.
7.
¿Cómo influyen los
puentes de hidrógeno en la diferencia de densidad del agua líquida y del agua
sólida?
8.
Los compuestos
orgánicos son insolubles en agua; sin embargo, existen compuestos, como el
metanol (
), que es soluble en
ella. ¿A qué se debe esta particularidad de los alcoholes?
9.
El xenón es uno de
los pocos gases que forman compuestos como el tetrafloruro de xenón (
. ¿Qué clase de
compuesto será? ¿Qué clase de fuerzas mantienen unidas sus moléculas? Argumenta
tú respuesta.
10. Consulta porque hoy día la mayoría de las personas prefieren
utilizar una crema dental que contenga flúor; seguramente, tú eres una de
ellas. ¿Sabes por qué el flúor puede ayudar a prevenir la caries?



Comentarios
Publicar un comentario