“El temor representa aceptar grandes desafíos, se ve reducido cuando decidimos confiar en el cuidado de Dios”
LEER
ATENTAMENTE LAS INDICACIONES ANTES DE TRANSCRIBIR.
NOTA:
La siguiente guía debe ser RESUELTA en el cuaderno del estudiante, por tanto,
debe ir tal y como se encuentra organizado, es decir con la fecha, semana y
tema.
OBSERVA EL VIDEO
Marzo
16 Al 20 de 2020
Semana 7
Área: Ciencias naturales -
Química
Grado: 10°
Competencia: indagación
Componente: ciencia
tecnología y sociedad
Evidencia de aprendizaje: Establece la relación entre la distribución de los
electrones en el átomo y el comportamiento químico de los elementos, explicando
cómo esta distribución determina la formación de compuestos, dados en ejemplos
de elementos de la Tabla Periódica.
Tema: Enlaces
químicos
Actividad
Introductoria
¿Cuáles son las
condiciones que deben cumplir los compuestos para estar unidos por un enlace
iónico?
INTRODUCCIÓN
El enlace iónico es
la unión resultante de la presencia de fuerzas electrostáticas entre iones positivos
y negativos para dar lugar a la formación de un compuesto constituido por una
red cristalina iónica.
ACTIVIDAD
1.
1.
Investiga que es un ion y como se determina la
valencia de cada uno de los átomos.
2.
Teniendo en cuenta, el ejemplo completa la
tabla.
Veamos, por ejemplo,
el potasio, K (Z = 19). Su estructura electrónica es
Si cede un electrón, adopta la configuración del gas noble argón (Z = 18).´
Por tanto, su
valencia iónica es 1+. Del mismo modo ocurre con otros elementos.
2. Teniendo en cuenta, el ejemplo completa la tabla.
Elemento
|
Z
|
Configuración
electrónica
|
Ion
|
Configuración
electrónica
|
Valencia iónica
|
Potasio
|
19
|
-1
|
|||
Aluminio
|
|||||
Calcio
|
|||||
Bromo
|
|||||
Fosforo
|
|||||
Vanadio
|
|||||
Cobre
|
|||||
Plata
|
|||||
Bario
|
|||||
Estaño
|
3. Investiga cuales
son las propiedades que tienen las sustancias con enlace iónico.
4. Plantea un ejemplo
de un enlace iónico, en el cual se pueda ver la combinación de las moléculas
Por ejemplo, la sal
en sí no puede conducir electricidad, pero si la diluimos en agua se separa en
sus iones y puede conducir corriente eléctrica como se muestra a continuación.
Actividad
2.
ENLACE
COVALENTE
Los enlaces
covalentes son producto de la unión de dos átomos que comparten uno o más pares
de electrones. Es el caso, entre otros muchos, de la molécula de flúor,  .
.
1. Consulta como se
realizan las estructuras de Lewis de las moléculas poliatómicas
A continuación, se
encuentran algunos ejemplos de los tipos de enlace covalente, de acuerdo con la
cantidad de electrones que se comparten.
Ejemplo determinación
de la cantidad de electrones que comparten las moléculas.
2. Representa,
mediante estructuras de Lewis, los siguientes compuestos:
3. Investiga la diferencia entre un enlace covalente
polar y no polar.
4.
Utilizando los valores de electronegatividad,
determina cuáles son polares y cuales son apolares. Justifica su
respuesta.
5.
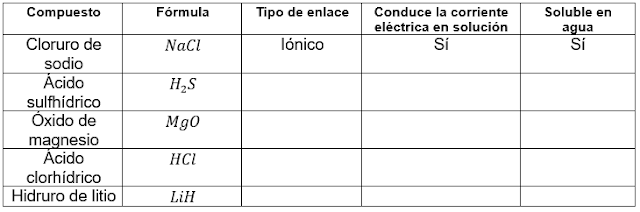
Teniendo en cuenta las propiedades y características
que confieren los enlaces a los compuestos, completa la siguiente tabla en tu
cuaderno.



Comentarios
Publicar un comentario